Nuove ricerche mostrano che il batterio della parodontite P. gingivalis può penetrare nel flusso sanguigno e raggiungere il cuore. Una volta lì, favorisce in modo silenzioso la formazione di tessuto cicatriziale, alterando la struttura cardiaca, interferendo con i segnali elettrici e aumentando il rischio di fibrillazione atriale
Fibrillazione atriale: il batterio della bocca che minaccia il cuore.
Un nuovo studio dell’Hiroshima University (HU) ha scoperto che il batterio della parodontite Porphyromonas gingivalis (P. gingivalis) può entrare nel flusso sanguigno e infiltrarsi nel cuore. Lì, provoca silenziosamente la formazione di tessuto cicatriziale — nota come fibrosi — alterando l’architettura cardiaca, disturbando i segnali elettrici e aumentando il rischio di fibrillazione atriale (AFib).
I clinici hanno da tempo osservato che le persone affette da parodontite, una comune malattia gengivale, sembrano più inclini a sviluppare problemi cardiovascolari. Una recente meta-analisi ha collegato la parodontite a un aumento del 30% del rischio (1) di sviluppare fibrillazione atriale (AFib), un disturbo potenzialmente grave del ritmo cardiaco che può provocare ictus, insufficienza cardiaca e altre complicanze potenzialmente letali. A livello globale, i casi di AFib sono quasi raddoppiati in meno di un decennio, passando da 33,5 milioni nel 2010 a circa 60 milioni nel 2019 (2). Ora la curiosità scientifica sta crescendo sul ruolo che potrebbe avere la malattia gengivale in questo incremento preoccupante.
Ricerche precedenti hanno indicato l’infiammazione come la probabile causa. Quando le cellule immunitarie nelle gengive si attivano per combattere un’infezione, i segnali chimici che rilasciano possono, in modo involontario, penetrare nel flusso sanguigno e alimentare un’infiammazione sistemica che potrebbe danneggiare organi lontani dalla bocca.
Ma l'infiammazione non è l’unica minaccia che fuoriesce dalle gengive infiammate. I ricercatori hanno individuato il DNA di batteri orali nocivi nel muscolo cardiaco, nelle valvole e persino nelle placche arteriose ricche di grassi. Tra questi, P. gingivalis ha attirato particolare attenzione per il suo sospetto coinvolgimento in un numero crescente di malattie sistemiche, tra cui Alzheimer, diabete e alcuni tipi di cancro. È stato rilevato in precedenza anche nel cervello, nel fegato e nella placenta. Tuttavia, il modo in cui riesce a insediarsi nel cuore è rimasto poco chiaro. Questo studio, pubblicato su Circulation (3), fornisce la prima prova concreta che P. gingivalis presente nelle gengive può insinuarsi nell’atrio sinistro, sia nei modelli animali che negli esseri umani, suggerendo un potenziale percorso microbico che collega la parodontite alla fibrillazione atriale (AFib).
Il dottor Shunsuke Miyauchi (4), primo autore dello studio e professore associato alla Graduate School of Biomedical and Health Sciences della Hiroshima University (HU), spiega: «La relazione causale tra parodontite e fibrillazione atriale è ancora sconosciuta, ma la diffusione dei batteri parodontali attraverso il flusso sanguigno potrebbe connettere queste due condizioni. Tra i vari batteri parodontali, P. gingivalis è altamente patogeno per la parodontite e alcune malattie sistemiche al di fuori della cavità orale. In questo studio, abbiamo affrontato due domande chiave: P. gingivalis si trasferisce all’atrio sinistro partendo dalla lesione parodontale? E se sì, provoca la progressione della fibrosi atriale e della fibrillazione atriale (AFib)?»
Gengive e cuore: il sorprendente collegamento con la fibrillazione atriale
Per simulare come P. gingivalis possa fuoriuscire dalla bocca e causare danni in altre parti del corpo, i ricercatori hanno sviluppato un modello murino utilizzando il ceppo aggressivo W83 del batterio. Hanno suddiviso topi maschi di 13 settimane in due gruppi: uno ha ricevuto l'inoculazione del ceppo nella polpa dentale, l'altro è rimasto non infettato. Ogni gruppo è stato ulteriormente diviso in sottogruppi e osservato per 12 o 18 settimane, al fine di valutare i rischi cardiovascolari legati a una esposizione prolungata.
La stimolazione intracardiaca — tecnica diagnostica per le aritmie — non ha rivelato differenze nel rischio di fibrillazione atriale (AFib) tra topi infetti e non infetti a 12 settimane. Ma alla 18ª settimana, i test hanno mostrato che i topi esposti al batterio avevano una probabilità sei volte maggiore di sviluppare ritmi cardiaci anomali, con un tasso di inducibilità di AFib del 30%, rispetto al solo 5% del gruppo di controllo.
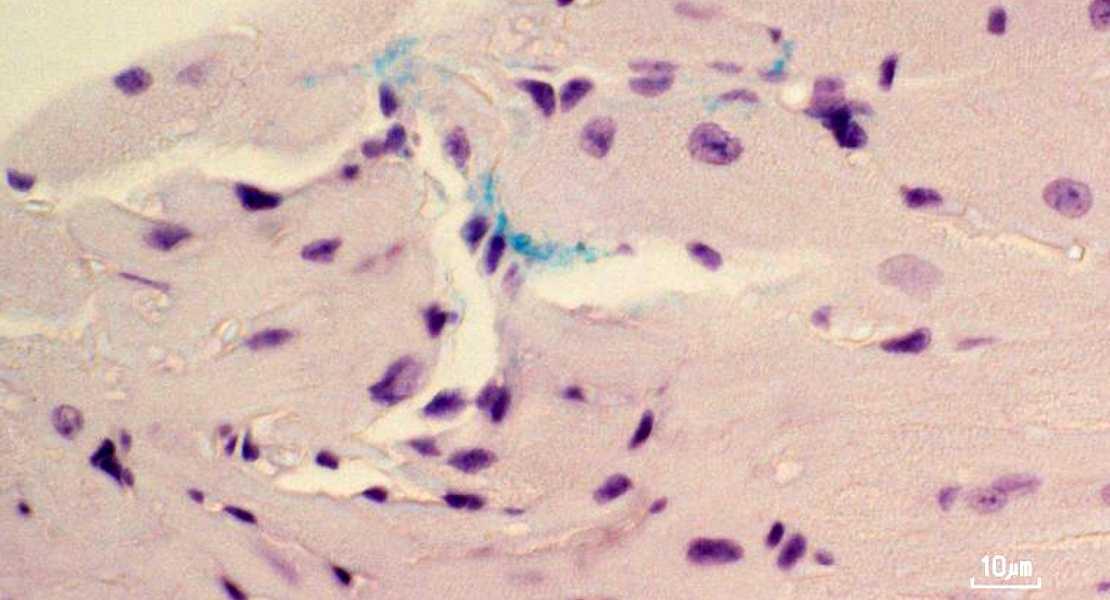
Per verificare se il modello riproducesse fedelmente la parodontite, i ricercatori hanno analizzato le lesioni mandibolari e rilevato segni caratteristici: decadimento della polpa dentale e microascessi causati da P. gingivalis. Il danno però non si è fermato lì: il batterio è stato identificato anche nell’atrio sinistro del cuore, dove il tessuto infetto risultava irrigidito e fibrotico. Grazie a una tecnica di amplificazione isoterma mediata da ciclo (LAMP), il team ha confermato la presenza del ceppo batterico nel cuore. Al contrario, i topi non infettati presentavano denti sani e nessuna traccia del batterio nei tessuti cardiaci.
Già a 12 settimane dall’infezione, i topi esposti a P. gingivalis mostravano più cicatrici cardiache rispetto ai controlli. Dopo 18 settimane, la fibrosi nei topi infetti era salita al 21,9%, contro il 16,3% (probabilmente legato all’età) nel gruppo di controllo — suggerendo che P. gingivalis non solo può provocare danni cardiaci precoci, ma anche accelerarne la progressione. E questo legame preoccupante non si è osservato solo nei topi. In uno studio separato su esseri umani, i ricercatori hanno analizzato tessuti dell’atrio sinistro di 68 pazienti con AFib sottoposti a chirurgia cardiaca. Anche lì è stata rilevata la presenza di P. gingivalis, soprattutto nei soggetti con grave malattia gengivale.
Maestro dell’Assalto Invisibile
Studi precedenti hanno dimostrato che il P. gingivalis può invadere le cellule ospiti ed evitare la distruzione da parte degli autofagosomi, il sistema di “smaltimento rifiuti” cellulare. Questa capacità di nascondersi all'interno delle cellule suggerisce un modo con cui il batterio riesce a sfuggire alle difese immunitarie, innescando un’infiammazione sufficiente a causare danni senza essere eliminato. I topi infettati hanno mostrato un aumento della galectina-3, un biomarcatore della fibrosi, e una maggiore espressione del gene Tgfb1, associato a infiammazione e formazione di cicatrici.
Le conclusioni suggeriscono che lavarsi i denti, usare il filo interdentale e fare controlli regolari dal dentista potrebbe avere benefici che vanno oltre l’igiene orale: mantenere le gengive in salute potrebbe impedire l’ingresso di P. gingivalis, proteggendo anche il cuore.
«P. gingivalis invade il sistema circolatorio attraverso le lesioni parodontali e si trasferisce all'atrio sinistro, dove la sua carica batterica è correlata con la gravità clinica della parodontite. Una volta nell'atrio, aggrava la fibrosi atriale, aumentando la predisposizione alla fibrillazione atriale (AFib)», ha dichiarato il dottor Mutsumi Miyauchi (5). «Pertanto, il trattamento parodontale, che può bloccare il passaggio del P. gingivalis, potrebbe avere un ruolo importante nella prevenzione e nel trattamento dell’AFib».
Il team è attualmente impegnato a rafforzare la collaborazione interdisciplinare tra medici e dentisti nella Prefettura di Hiroshima per migliorare la cura cardiovascolare.
«Il prossimo passo sarà indagare i meccanismi specifici con cui P. gingivalis colpisce i cardiomiociti atriali», ha detto Miyauchi. «Stiamo anche lavorando per creare un sistema collaborativo medico-odontoiatrico nella Prefettura di Hiroshima per trattare le malattie cardiovascolari, inclusa la fibrillazione atriale. L’obiettivo è espandere questa iniziativa a livello nazionale in futuro».
Altri coautori nello studio includono: l'HU School of Dentistry’s Miki Kawada-Matsuo, Hitoshi Komatsuzawa del Department of Bacteriology, Hisako Furusho, Ayako Nakajima, Pham Trong Phat, Masae Kitagawa, Mutsumi Miyauchi del Department of Oral e il Maxillofacial Pathobiology, Kazuhisa Ouhara del Department of Periodontal Medicine; l'Hiroshima University Hospital’s, Hiromi Nishi, Hiroyuki Kawaguchi del Department of General Dentistry, Noboru Oda, Takehito Tokuyama, Yousaku Okubo, Sho Okamura, Yukiko Nakano del Department of Cardiovascular Medicine, Toru Hiyama della Division of General Medicine; HU Collaborative Research Laboratory dell'Oral Inflammation Regulation’s Fumie Shiba; e l'HU School of Medicine’s, Taiichi Takasaki e Shinya Takahashi del Department of Surgery.
Riferimenti:
(2) Global Burden of Cardiovascular Diseases and Risk Factors, 1990–2019: Update From the GBD 2019 Study
(3) Atrial Translocation of Porphyromonas gingivalis Exacerbates Atrial Fibrosis and Atrial Fibrillation
(5) Mutsumi Miyauchi
Descrizione foto: La colorazione immunoistochimica nei topi mostra Porphyromonas gingivalis (in verde) che entra nel muscolo cardiaco attraverso piccoli vasi sanguigni nell’atrio sinistro. - Credit: Shunsuke Miyauchi/Hiroshima University.
Autore traduzione riassuntiva e adattamento linguistico: Edoardo Capuano / Articolo originale: Heart rhythm disorder traced to bacterium lurking in our gums